醫學院林水龍老師、朱宗信老師與周鈺翔老師的研究團隊發表成果於The Journal of Clinical Investigation
急性腎損傷與慢性腎臟病在全球都逐年增加,這些病人若進展至末期腎臟病,相關的治療需要投入龐大的醫療費用。雖然臨床上已有許多治療可延緩慢性腎臟病惡化,但並無法完全阻止末期腎臟病發生。對於急性腎損傷的治療除了支持療法以幫助病患渡過難關,目前並無有效的治療。許多獨立的研究團隊都發現急性腎損傷是造成慢性腎臟病的重要危險因子,團隊更發現急性腎損傷患者就算腎功能在支持治療下恢復,經過八年的追蹤,有超過八成的患者會罹患慢性腎臟病或末期腎臟病。所以研究急性腎損傷進展至慢性腎臟病的機轉進而研發治療的藥物與策略至為重要,也給急性腎損傷發生期間提供一個明確的介入期。
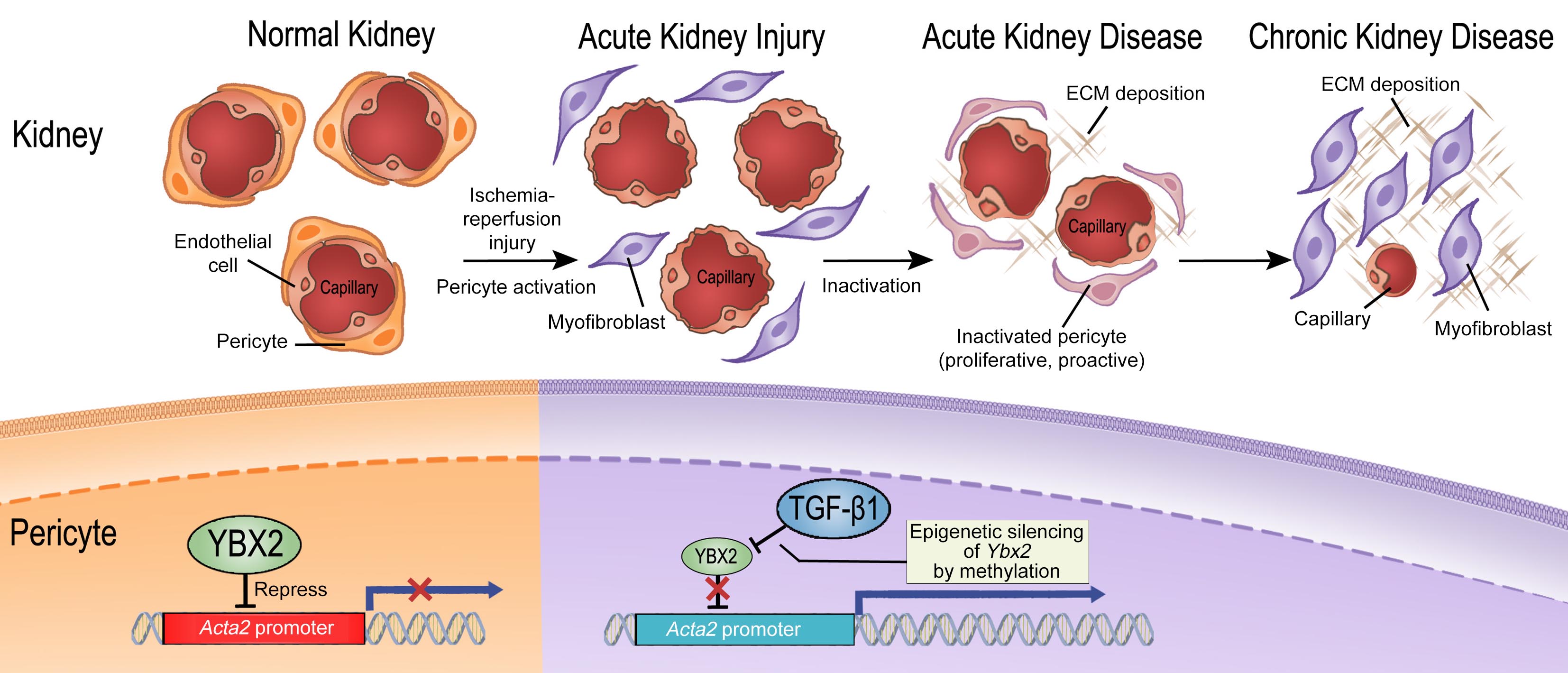
腎臟纖維化是各種慢性腎臟病的共同病理生成機轉,因此剖析腎臟纖維化的機轉與可能的治療標的是相當重要的研究課題。我們研究團隊(圖一)之前已證實腎臟血管周細胞在慢性腎臟病的進展過程中,不僅會喪失製造促紅血球生成素與穩定微血管的功能,還會轉分化成肌纖維母細胞以造成腎臟纖維化。由於超過八成急性腎損傷的病患在八年追蹤當中會罹患慢性腎臟病,因此本研究的假說是血管周細胞在急性腎損傷中發生的變化會促成後續慢性腎臟病的發生。
首先我們在急性缺血性腎損傷的動物研究中,證實腎臟血管周細胞會大量增生並被活化。但在腎功能恢復後,增生活化的血管周細胞約有20%仍會留存在腎臟中,且轉錄體分析顯示這些存活下來的血管周細胞與正常休止期及急性腎損傷活化狀態的細胞不同,團隊定義他們處於去活化狀態,持續表現介於休止與活化狀態的Acta2基因,並保持容易增生、促纖維化作用及失去穩定微血管的作用。由於研究發現急性腎損傷的腎臟在功能恢復之後,在追蹤過程中會再度發生血管周細胞增生與活化,腎臟纖維化與功能惡化,而且若發生再次的急性腎損傷會表現出更惡化的腎臟纖維化,功能受損與腎臟血管周細胞增生,經由研究證實急性腎損傷會造成血管周細胞的基因體發生高度甲基化,促使去活化的血管周細胞仍保有容易增生、促纖維化的記憶,並喪失穩定微血管的作用。
在轉錄體分析中,團隊發現包括Ybx2在內的四個轉錄因子在去活化的血管周細胞仍保持較低的表現量,且細胞實驗證實降低YBX2表現會促成Acta2基因與其基因產物甲型平滑肌動蛋白(SMA)的表現增加以活化血管周細胞,而表現YBX2則會藉由抑制Acta2基因轉錄防止血管周細胞活化(圖二)。進一步的研究證實急性腎損傷會透過增加乙型轉化生長因子(TGF-1)造成血管周細胞的Ybx2基因甲基化,YBX2蛋白表現降低,血管周細胞增加表現SMA與活化。在急性腎損傷時期給予動物去甲基化藥物(5-azacytidine)治療,證實可阻止後續腎臟纖維化與慢性腎臟病的發生。
在本研究發現之前,學界普遍認為尚無任何治療可阻止急性腎損傷後發展成慢性腎臟病與末期腎病。本研究成果發表2020年8月4日的The Journal of Clinical Investigation (臨床研究雜誌)。臨床研究雜誌的主編與審查者讚賞本研究適時解決「無方法可治療或防止急性腎損傷進展成慢性腎臟病」的難題,並「開啟急性腎損傷進展至慢性腎臟病的研究與治療的新頁」,了解血管周細胞在急性腎損傷後會被活化,且有部分血管周細胞持續存在恢復腎功能的腎臟中卻因基因的甲基化保持著介於休止與活化之間的狀態,其中新發現的YBX2蛋白是肌纖維母細胞活化的重要基因Acta2的抑制因子,YBX2蛋白會因為其基因受到甲基化而被抑制表現,使得去活化的血管周細胞保持促成慢性腎臟病的記憶,並容易在遭受再次急性腎損傷時表現出更為惡化的腎臟功能與病理。因為急性腎損傷的發生標記未來發生慢性腎臟病的高度風險,團隊期待在後續的臨床試驗中證實「使用去甲基化的藥物抹除表觀遺傳記憶可阻止急性腎損傷進展至慢性腎臟病」。果能如此,將大幅促進人類健康與減少慢性腎臟病相關的治療支出。