臺大生化所冀宏源教授團隊發現多胺如同細胞DNA修補系統的蠻牛
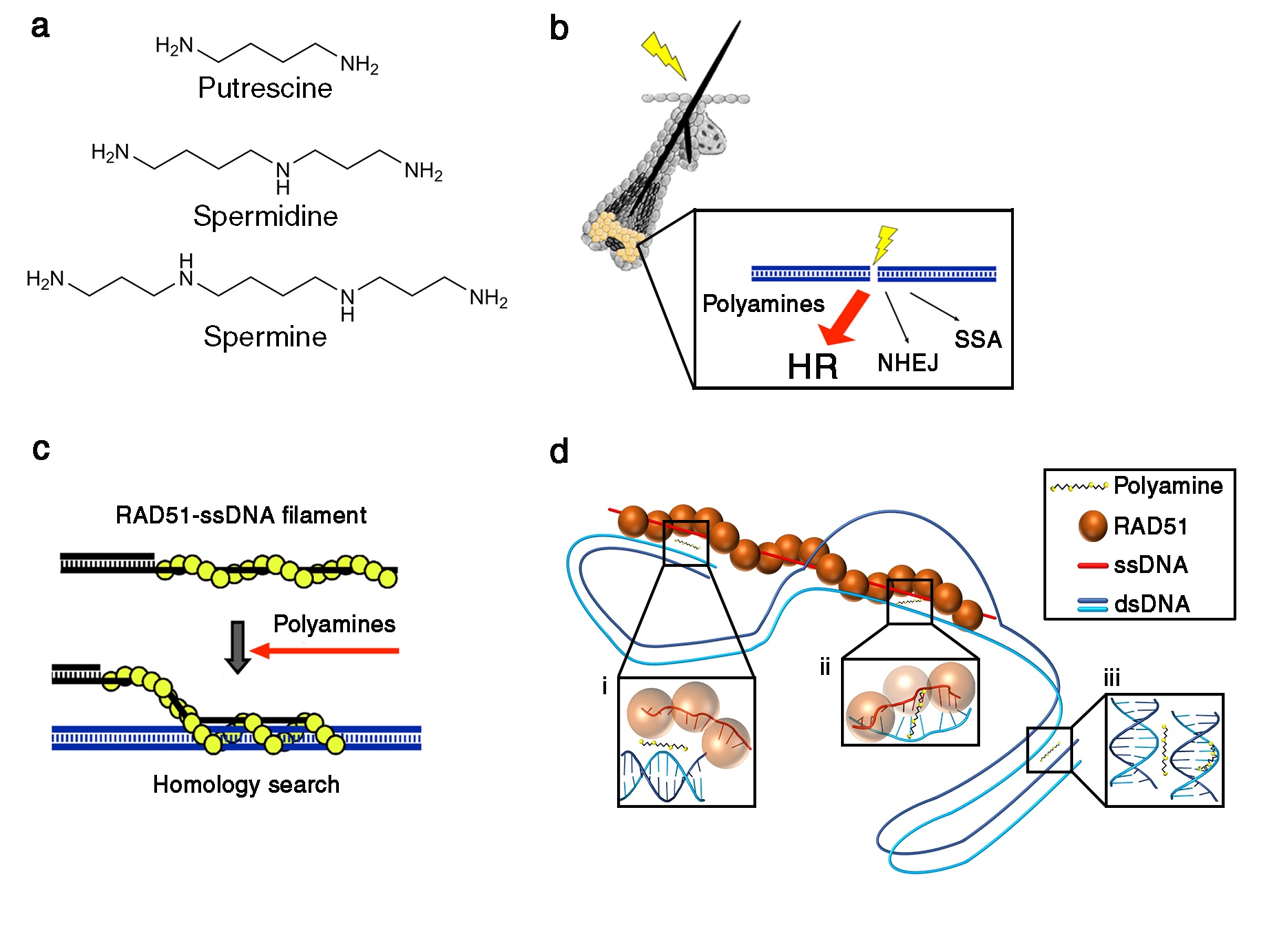
國立臺灣大學生化科學研究所冀宏源教授領導的研究團隊發現,細胞內自然存在的帶正電小分子多胺 (polyamines, 結構如圖1a),在DNA修復過程中扮演至關重要的角色,就猶如細胞的能量飲”蠻牛”一般,可促進細胞的DNA修補系統,以應付環境諸多可能對基因體所造成傷害。透過以毛囊的動物模式、一連串精細的細胞實驗、及生化學的研究方法,他們的研究證明,多胺專一性地促進同源重組系統所催化的DNA雙股斷裂修復 (圖1b)。值得注意的是,比起正常細胞,大部分的癌細胞常常帶有高量的多胺以幫助其存活,因此,他們的研究成果為癌症治療的方向提供了新策略。這項研究結果已刊登於國際頂尖科學期刊Nature Communications。
當細胞內的DNA遭受到外來物質的攻擊,如致癌物、輻射線等,甚至是細胞在複製過程中發生問題,導致DNA產生雙股斷裂時,同源重組修復系統扮演著不可或缺的修補角色。同源重組修復系統是由RAD51重組酵素結合在DNA受損位置並組裝成核蛋白絲的結構 (RAD51 filament, 圖1c),開始在細胞核內進行同源模板搜索(homology search) 尋找帶有同源序列的雙股DNA,並在搜尋成功的同源位置催化DNA的交換,以便後續作為修補模板及合成DNA來修復斷裂DNA序列,因此,同源重組修復系統對於維持細胞基因組完整性非常重要。然而,同源重組修復反應仍有許多未知的課題值得科學家們研究,例如:RAD51重組酵素如何能夠在茫茫大海的基因組內找到唯一的同源模板進行修復?而在細胞內有哪些分子可影響同源模板搜尋的效率,更是在學界中未解的關鍵問題。
在這項研究中,研究團隊(圖2)首次提供了多胺專一性促進同源重組 (homologous recombination; HR) 修復系統的證據,而非其他的DNA修復途徑,如:非同源DNA末端連接 (non-homologous end joining; NHEJ) 和單股DNA連結反應的修復系統 (single-strand annealing; SSA) (圖1b)。機制上,多胺透過增強RAD51酵素在同源模板搜索過程中的雙股DNA結合能力,達到顯著刺激RAD51的DNA股交換活性以利後續修復受損的DNA (圖1c)。
第一作者,李致瑩博士(圖3)提出了三種可能的分子機轉來解釋多胺如何刺激RAD51酵素所催化的同源模板搜尋 (圖1d)。首先,多胺可以吸引RAD51核蛋白絲和雙股DNA碰撞 (圖1d,插入框i),就像磁鐵一般幫助DNA斷裂位置更快在細胞核內找尋修補模板。其次,多胺利用穩定單股DNA (ssDNA) 與同源的雙股DNA (dsDNA) 模板之間的配對 (圖1d,插入框ii),讓RAD51酵素檢查是否有尋找到正確的模板可以往下進行複製及修復。最後,細胞核內龐大的基因組就好比散亂的毛線,多胺小分子可以利用聚集雙股DNA的方式,好比集線器來將毛線聚集,使得RAD51核蛋白絲可以一次同時在多個區域中尋找同源性DNA (圖1d,插入框iii),而不用跑遍整個細胞核,可以更有效率地進行同源模板搜尋。李博士說 : 「多胺就好比細胞的蠻牛,幫助DNA修補系統維持活力旺盛。」
此基礎研究也有重要的臨床治療意義,由於癌細胞和正常細胞相較,帶有過量的多胺,因此預期癌細胞的DNA修復活性也會升高,使得癌細胞更難被殺死。研究團隊發現,小分子藥物二氟甲基鳥氨酸 (DFMO) 可顯著降低細胞內的多胺含量,導致DNA修補系統活性降低。令人興奮的是,他們的團隊也證明二氟甲基鳥氨酸可搭配放射線治療,或是搭配美國食品藥品監督管理局 (FDA) 所核准的藥物奧拉帕尼 (olaparib),皆可有效抑制癌細胞存活。值得注意的是,二氟甲基鳥氨酸藥物正在進行神經母細胞瘤的二期臨床試驗,且結果有顯著的治療效用。 「因此,我們的研究發現提供癌症治療新的想法及治療策略,來迫使癌細胞的DNA修補能力下降,以達到殺死癌細胞的目的。」冀宏源教授這麼說。
論文全文現已發表在Nature Communications,由李致瑩博士、蘇綸勤博士、黃文彥博士、柯旻佑、葉欣怡博士、張震東教授、林頌然教授及冀宏源教授等共同完成。也特別感謝臺大、中研院、以及科技部對此研究的支持。