分子醫學研究所劉雅雯老師團隊論文成果發表《Journal of Cell Biology》
醫學院分子醫學研究所劉雅雯老師團隊近日發表論文,首度揭開哺乳類生物骨骼肌肉細胞融合的分子機制。此新發現將提供研究細胞融合與肌肉病變的新方向,也為發展抑制癌細胞轉移藥物提供新策略。該論文於2019年3月刊登於細胞生物學領域重要國際期刊利
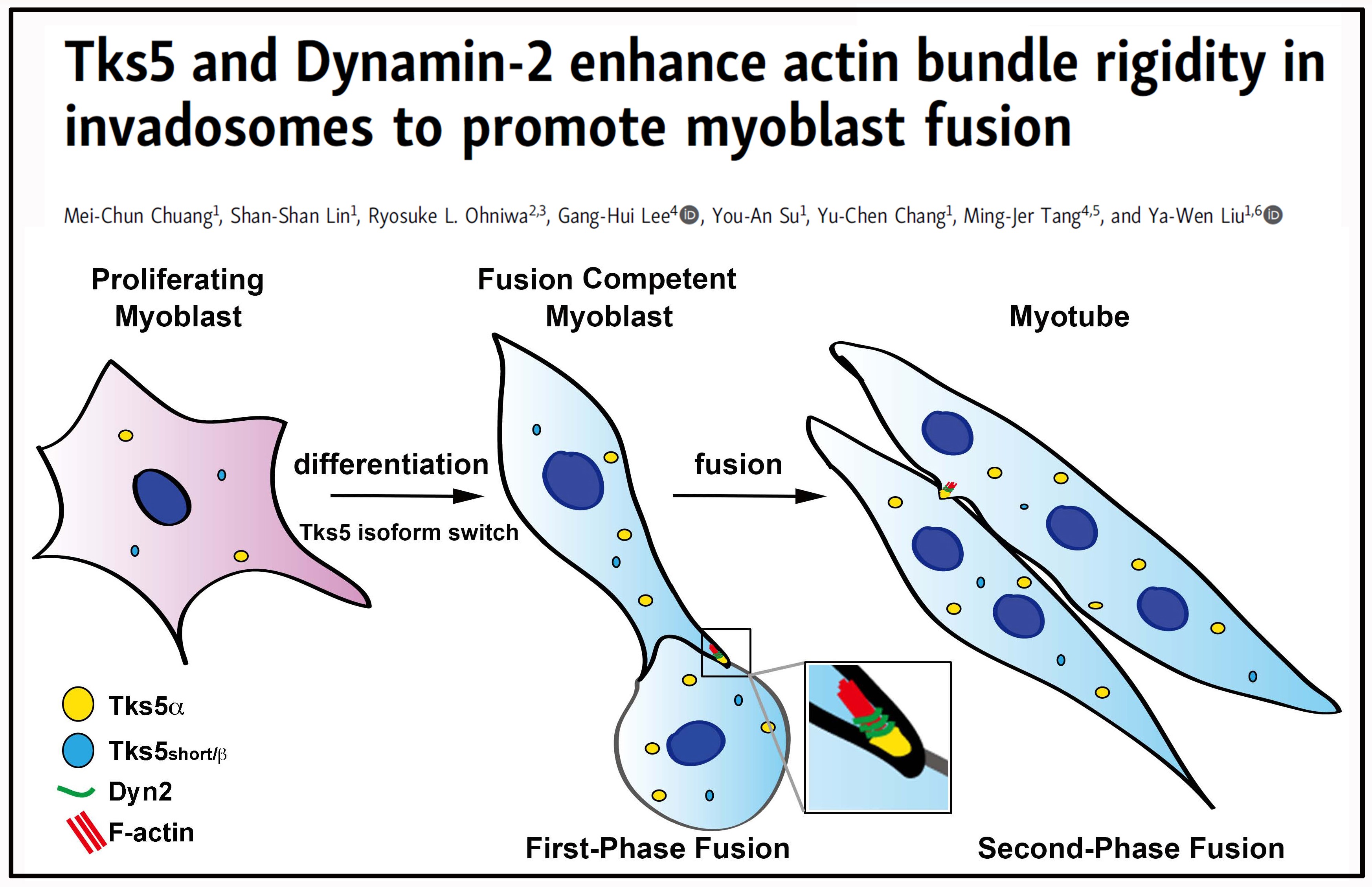
終其一生,人類的骨骼肌都不停地經歷受損、刺激、以及肌纖維母細胞的分化與再生。其中肌纖維母細胞間的融合是肌肉生成的一個重要步驟,然而科學界對於肌肉細胞如何在分化後獲得細胞融合的能力,以及肌肉細胞進行細胞融合的分子機制仍不清楚。本篇論文的第一作者莊梅均同學,在碩士班時期利用小鼠的肌纖維母細胞C2C12進行研究,發現肌肉細胞是利用一種特殊的肌動蛋白結構-侵襲體(invadosome,在癌細胞中被稱為侵襲性偽足),進行細胞間的融合。逕讀博士班時期,著迷於這一有趣生理現象的莊同學學習並利用多種實驗系統,花了四年的時間終於徹底解開了肌肉細胞融合的分子機制。
藉由活細胞縮時影像技術,研究團隊證明了侵襲體會在細胞融合前形成,並產生不對稱的分布;利用細胞生物、分子生物及生物化學上的實驗技術,我們發現侵襲體是藉肌肉細胞分化時肌肉形成轉錄因子所調控的侵襲體銜接蛋白Tks5亞型轉換而形成,而Tks5 a 型的表達,不僅讓肌肉細胞具有產生形成侵襲體的能力,更會透過蛋白質連結的方式讓一新型的肌動蛋白…(全文詳網頁)2產生結構上的改變,使肌動蛋白絲成為巨大的肌動蛋白束。莊梅均同學也結合高解析度影像技術,利用穿透式電子顯微鏡證明了Tks5與Dynamin-2共同作用在肌動蛋白束的鏈結形成並以螺旋狀纏繞在肌動蛋白束上。而這樣特殊的結構,也可利用超解析螢光顯微鏡在肌肉細胞中觀察到。
為求更進一步的了解這一巨大且新穎的肌動蛋白結構之物理與生化特性,我們與日本筑波大學的大庭良介老師合作,學習使用原子力顯微鏡來測量肌動蛋白束之結構及硬度,我們驚喜地發現Tks5會使得Dynamin-2所產生的肌動蛋白束硬度增加一倍。為了證明這一嶄新的生物力學發現,我們與成功大學的湯明哲教授合作,利用生物性原子力顯微鏡進行活細胞中侵襲體的硬度測量,驗證了在體內與體外實驗中,Tks5與Dynamin-2都參與在侵襲體的形成以及其硬度的增加。
侵襲體不僅在正常的生理功能上扮演著重要的角色,在疾病上更是惡名昭障!目前研究發現侵襲體正是癌細胞轉移的重要機制。因此,我們的研究成果不僅對肌肉發育與再生的了解有相當程度貢獻。另一方面,對於開發抑制癌症轉移的治療策略也非常有幫助。莊梅均同學也正與實驗室同儕合作研究,利用她發現的侵襲體形成機制來進行抑制藥物的開發,目前已有非常好的進展。本篇論文共同作者包括劉老師實驗室的林珊珊、蘇佑安、張瑜真同學、筑波大學大庭良介教授,以及成功大學湯明哲教授與李耕琿博士後研究員。
參考網站: Tks5 and Dynamin-2 enhance actin bundle rigidity in invadosomes to promote myoblast fusionhttp://jcb.rupress.org/content/early/2019/03/19/jcb.201809161.long